9月6日晚,国家医保局官网发布了《关于公示2022年国家基本医疗保险、工伤保险和生育保险药品目录调整通过初步形式审查的药品及相关信息的公告》(简称《公告》),显示共有344个药品通过初步形式审查。
公示时间为2022年9月6日—9月12日。公示期间,社会各界可对公示药品的资格条件、相关信息和初步形式审查结果进行监督。

1.申报和通过的药品数量都有一定增加。据国家医保局官方统计,此次目录调整的申报阶段,国家医保信息平台共收到企业申报信息537条,涉及药品(通用名,下同)490个。经审核,344个药品通过初步形式审查,其中目录外药品通过审查为199个,通过比例为60%,目录内药品通过审查为145个,通过比例为91%;整体通过比例为70%。
2021年为474个药品271个通过,整体通过比例57.2%。相比之下,申报和通过初步形式审查的药品数量都有一定增加。
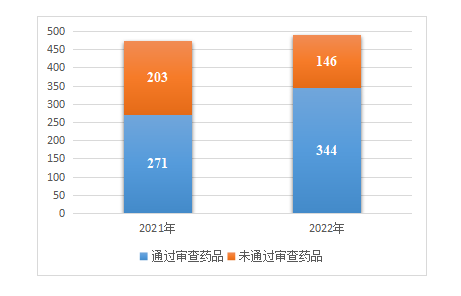
图 2022年与2021年通过初步形式审查的药品数量变化情况
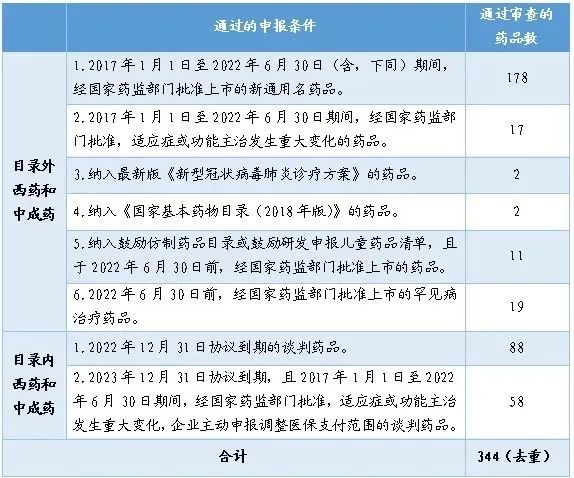
(注:“目录外西药和中成药”中有24个品种同时符合2个申报条件,3个品种同时符合3个申报条件;“目录内西药和中成药”中有1个品种同时符合2个申报条件。每个申报条件统计时单独计入,整体统计时已予以合并)表 2022年通过初步形式审查药品的“通过申报条件”分布情况
2.继续支持创新药品。医保药品目录准入的范围聚焦于上市新药,通过谈判将临床价值高、经济性评价优良,但价格较为昂贵的专利、独家品种及时纳入医保目录,是医保对医药产业创新发展支持的最直接体现。自2020年目录调整改为申报制以来,5年内获批的新药一直是申报条件之一,创新性同样为目录评审的重要内容。部分创新药上市当年即被纳入国家医保目录,迅速推向市场。本次通过初步形式审查的药品中,近五年批准上市的新通用名药品为178个,占目录内药品通过审查数量的比例为89.4%。
3.罕见病、儿童用药重点关注。今年医保药品目录充分体现了对罕见病治疗药物、儿童用药的关注,将“2022年6月30日前经批准上市的罕见病治疗药品”“2022年6月30日前经批准上市并纳入鼓励研发申报的儿童药品清单的药品”明确列入申报条件,且并无“2017年1月1日后上市”等条件限制,明确体现出今年医保目录对儿科用药和罕见病用药的倾斜。本次通过初步形式审查审查的儿童用药、罕见病用药分别为11个和19个。而据国家医保局统计,2021年国家医保药品目录调整中新增的罕见病用药为7种。
4.评审方式和评审流程更加优化。相比于去年,2022年的医保目录调整工作方案中对于评审方式和评审流程都做了一些完善。在此基础上,国家医保局进一步优化了企业申报的内容,进一步丰富了申报资料中对药品提交信息的要求,包括有效性、安全性、经济性、创新性和公平性等,并请企业提交药品信息摘要幻灯片,给予企业更多机会向专家介绍自己的品种。
按照《基本医疗保险用药管理暂行办法》,国家医保药品目录调整实行企业申报制。自施行申报制以来,国家医保药品目录调整工作方案,确定申报条件和要求,各申报主体自愿申报。对药品申报资料进行初步形式审查,一方面可以确保申报的药品符合申报条件,另一方面对申报资料的完整性、规范性进行审核,并根据工作需要就一些资料的真实性向有关方面进行核实,有利于保证提供给专家的信息更加准确完整。
同时,为主动接受社会监督,确保形式审查结果准确,国家医保局对通过初步形式审查结果的药品和部分信息进行公示。并且,考虑到药品的经济性大多涉及企业商业机密和核心利益,企业提交的药品申报资料中与经济性相关的信息未予公示。
需要明确的是,通过初步形式审查并不意味着一定会被纳入国家医保药品目录。按照《基本医疗保险用药管理暂行办法》和2022年医保目录调整工作方案,医保药品目录调整分为企业申报、形式审查、专家评审、谈判竞价等环节,形式审查只是其中之一。通过形式审查,表明该药品有资格进入下一步的专家评审环节,最终能否进入国家医保药品目录,还需要进行包括有效性、安全性、经济性、创新性和公平性等多方位严格评审。并且,通过评审的独家药品要经过谈判、非独家药品要经过竞价,只有谈判或竞价成功,才能最终被纳入国家医保药品目录。
按照《2022年国家基本医疗保险、工伤保险和生育保险药品目录调整工作方案》,医保药品目录调整分为企业申报、形式审查、专家评审、谈判竞价等环节。这意味着,药品顺利通过形式审查后,后面还要经过诸多环节,才能最终进入国家医保目录。
公示结束后,国家医保局将根据公示期间收到的反馈意见,进一步核实相关信息,确定最终通过形式审查的药品范围,并向社会进行公布。随后,按计划推进专家评审、谈判竞价等后续工作。根据此前发布的工作方案,具体程序包括:
专家评审
1.根据企业申报情况,建立评审药品数据库。论证确定评审技术要点。组织药学、临床、药物经济学、医保管理、工伤等方面专家开展联合评审。经评审,形成拟直接调入、拟谈判/竞价调入、拟直接调出、拟按续约规则处理等4方面药品的建议名单。同时,论证确定拟谈判/竞价药品的谈判主规格、参照药品和医保支付范围,以及药品目录凡例、药品名称剂型、药品甲乙类别、目录分类结构、备注等调整内容。
2.对于简易续约的药品,组织专家按规则确定下一个协议期的支付标准。
3.反馈结果。通过申报系统向相关企业反馈结果。
谈判/竞价
1.完善谈判/竞价药品报送材料模板。
2.根据企业意向,组织提交相关材料。
3.开展价格测算评估。组织测算专家通过基金测算、药物经济学等方法开展评估,并提出评估意见。
4.加强沟通交流。建立与企业的沟通机制,对企业意见建议及诉求进行登记并及时回应。就药品测算评估的思路和重点与企业进行面对面沟通,及时解决问题。
5.开展现场谈判/竞价。根据评估意见组织开展谈判/竞价,现场签署谈判/竞价结果确认书。对谈判/竞价成功的药品,确定全国统一的医保支付标准,明确管理要求。
6.组织谈判成功和简易续约的企业签署协议。
附件:

